
Евразийская экономическая комиссия (ЕЭК) утвердила решение №65 от 23.05.2023, которым внесла изменения в Правила классификации медицинских изделий в зависимости от потенциального риска применения, утвержденные Решением Коллегии ЕЭК от 22 декабря 2015 г. № 173.
В новой редакции Правил появился отдельный раздел «IV. Классификация программного обеспечения, являющегося медицинским изделием».
Для программных медицинских изделий (ПМИ) определены 4 класса потенциального риска применения: 1, 2а, 2б и 3 – для низкого, среднего, повышенного и высокого риска соответственно.
Если программное медицинское изделие не использует технологии искусственного интеллекта, то определение класса потенциального риска осуществляется на основе условий (клинического сценария) применения и вида выдаваемой информации и ее влияния на принятие медицинских решений, представленных следующей таблицей:
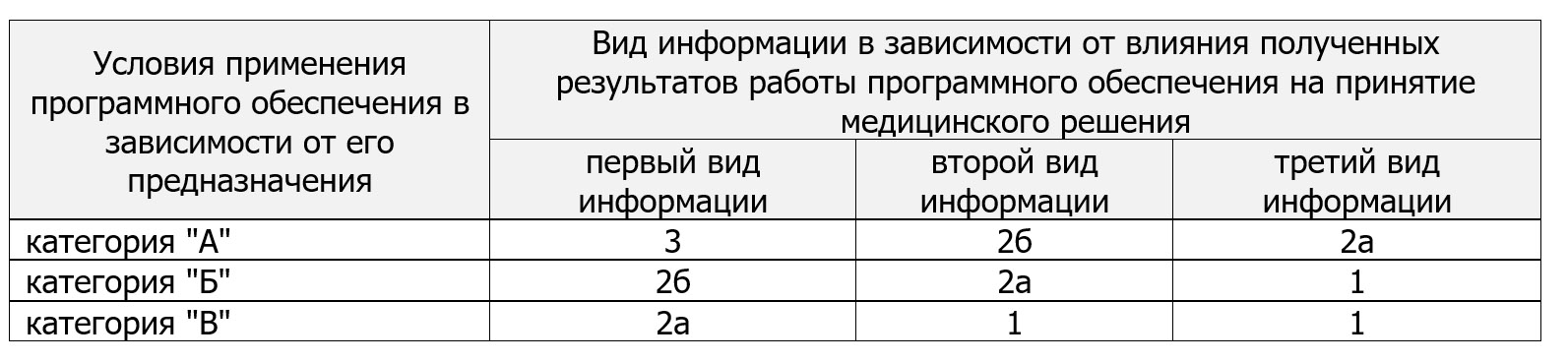
Данный подход, в свою очередь, основан на рекомендациях «IMDRF/SaMD WG/N12: 2014 Software as a Medical Device: Possible Framework for Risk Categorization and Corresponding Considerations», принятых IMDRF в 2014 г. и доступных по адресу: https://www.imdrf.org/documents/software-medical-device-possible-framework-risk-categorization-and-corresponding-considerations.
Пунктами 46 и 48 детализированы правила определения класса риска в зависимости от различных условий применения и видов информации, выдаваемых ПМИ. В приложении №4 приведены отдельные примеры устанавливаемого класса риска в зависимости от предназначения ПМИ.
Программные медицинские изделия, использующие в своей работе технологии искусственного интеллекта, отнесены к 3му (максимальному) классу риска – точно также, как это уже было ранее сделано в национальных правилах регистрации медизделий, принятых в России.
Новые положения вступят в силу 22.11.2023.
Официальный текст решения №65 доступен на Правовом портале ЕАЭС по адресу: https://docs.eaeunion.org/docs/ru-ru/01439757/err_26052023_65