Материал обновлен в январе 2019 г. в связи изданием нормативных актов Правительства РФ.
Об истории создания системы
Решение о создании федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки(далее ФГИС МДЛП) было принято 4 февраля 2015г на совещании Президента РФ Владимира Путина с членами Правительства. Согласно подписанному 20 февраля 2015 г. поручению №Пр-285, Министерству здравоохранения было поручено обеспечить разработку и поэтапное внедрение системы, http://kremlin.ru/acts/assignments/orders/47725
Во исполнение поручения № Пр-285 30.11.2015 г. Минздравом РФ был издан приказ № 866 «Об утверждении концепции создания федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки», которым была утверждена общая концепция создания системы, цели и задачи, перечень функциональных возможностей и сервисов, а также основные требования к системе https://www.rosminzdrav.ru/documents/9490-prikaz-ot-30-noyabrya-2015-g-n-866-ob-utverzhdenii-kontseptsii-sozdaniya-federalnoy-gosudarstvennoy-informatsionnoy-sistemy-monitoringa-dvizheniya-lekarstvennyh-preparatov-ot-proizvoditelya-do-konechnogo-potrebitelya-s-ispolzovaniem-markirovki.
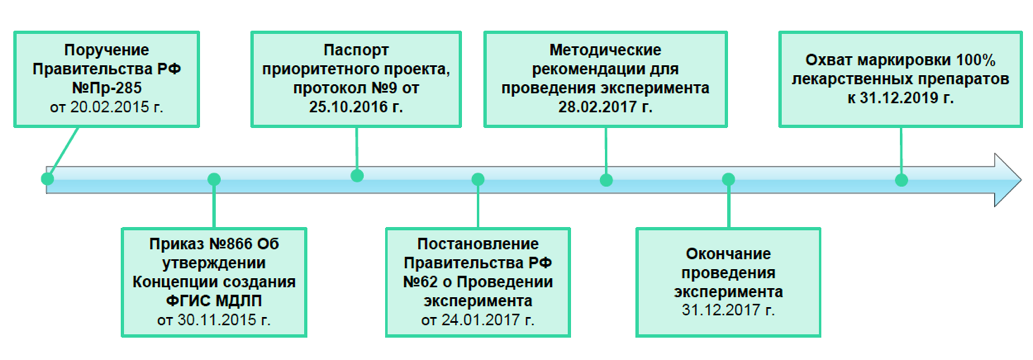
Временная шкала, иллюстрирующая установленный изначально механизм подготовки и запуска системы, показана на рисунке ниже.
Общее описание системы и участники проекта
Разрабатываемая система призвана защитить население от нелегальных лекарственных средств, предоставить гражданам и организациям возможность оперативной проверки их легальности, противодействие незаконному производству, ввозу, обороту лекарственных препаратов на территории Российской Федерации, противодействие недобросовестной конкуренции в сфере оборота лекарственных препаратов, стандартизация и унификация процедур учета поставок и распределения лекарственных препаратов, в том числе закупаемых для государственных нужд.
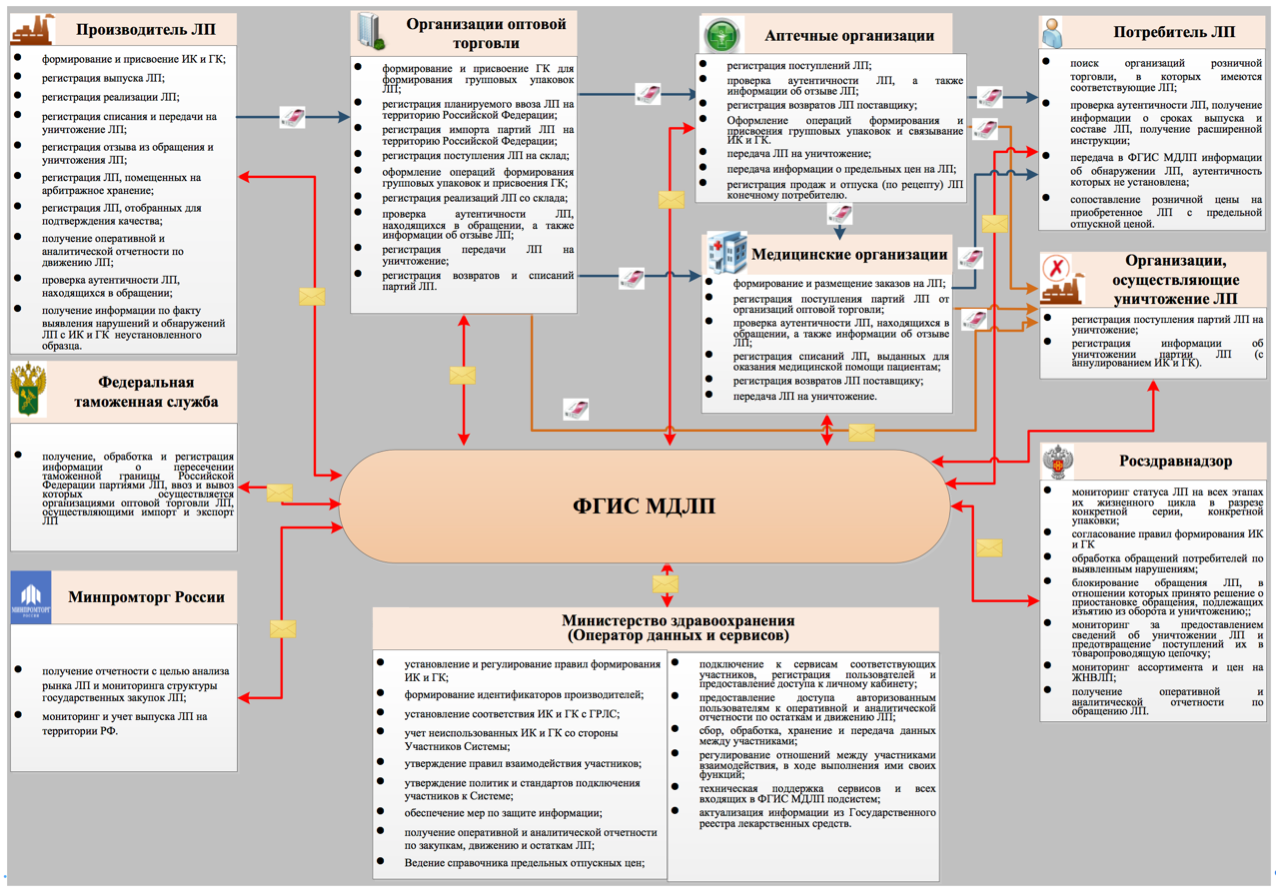
Общая функциональная схема системы приведена на рисунке ниже.
Постановлением Правительства РФ от 24.01.2017 г. № 62 "О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения" разработчиком и оператором системы МДЛП была определена Федеральная налоговая служба (ФНС). При этом сроком окончания эксперимента по маркировке и мониторингу за оборотом отдельных видов лекарственных препаратов было установлено 31.12.2017 г. Последующими редакциями указанного выше постановления срок окончания эксперимента был перенесен на 31.12.2018 г. Постановлением Правительства РФ от 28.08.2018 № 1018 с 01.11.2018 г. срок окончания эксперимента перенесен на 31.12.2019 г. Этим же постановлением ФНС прекратила информационное сопровождение системы МДЛП С 01.11.2018 г. Информационное сопровождение системы МДЛП (в добровольном порядке) передано обществу с ограниченной ответственностью "Оператор-ЦРПТ", https://честныйзнак.рф/business/projects/21/#.
Полномочия ООО «Оператор-ЦРПТ» как оператора информационной системы мониторинга движения лекарственных средств подтверждены также распоряжением Правительства РФ от 18.12.2018 г. № 2828-Р (https://medvestnik.ru/content/documents/2828-r-ot-18-12-2018-g.html).
Подробная информация о ходе реализации проекта публикуется на сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзора) http://roszdravnadzor.ru/marking.
Федеральными органами исполнительной власти, уполномоченными на обеспечение проведения эксперимента, являются Министерство здравоохранения Российской Федерации, Министерство промышленности и торговли Российской Федерации, Федеральная служба по надзору в сфере здравоохранения и Федеральная налоговая служба.
Уже сейчас для свободного скачивания доступно разработанное ФМС приложение для смартфонов «Проверка маркировки товаров» (https://play.google.com/store/apps/details?id=ru.fns.markirovka), позволяющее путем сканирования штрих-кода получить информацию о происхождении упаковки лекарства и убедиться, что препарат легален (правда испытать приложение пока проблематично – еще не завершен тестовый эксперимент по нанесению штрих-кодов на упаковки отдельных групп лекарств). Аналогичное приложение разрабатывается и новым оператором системы МДЛП ООО "Оператор-ЦРПТ": https://честныйзнак.рф/potrebitelyam/.
По такому же принципу, только с использованием специализированных приборов, сканеров, предполагается проводить проверку подлинности лекарственных средств в аптеках и медицинских учреждениях при получении их от поставщика. Помимо этого внедрение системы позволит получать детальные сведения о перемещении упаковки, а также информацию, которая делает невозможным дальнейшее ее обращение (например, наличие данных о том, что упаковка была ранее продана или выведена из обращения по какой-либо другой причин).
Непосредственными пользователями системы станут все субъекты обращения лекарственных препаратов (ЛП), а именно:
- российские производители ЛП,
- иностранные держатели регистрационных удостоверений ЛП и их представительства,
- организации оптовой и розничной торговли ЛП (аптеки),
- медицинские организации (МО).
Планируется, что по результатам реализации проекта будут задействованы более 350 тысяч субъектов.
Изучение блок-схемы организационного взаимодействия участников (рис. ниже), показывает, что ФГИС МДЛП позволит отслеживать каждое движение лекарственного препарата, начиная с момента его выпуска из производства и заканчивая реализацией конечному потребителю (передачей в медицинские организации для оказания медпомощи, выводом из оборота, списанием или уничтожением).
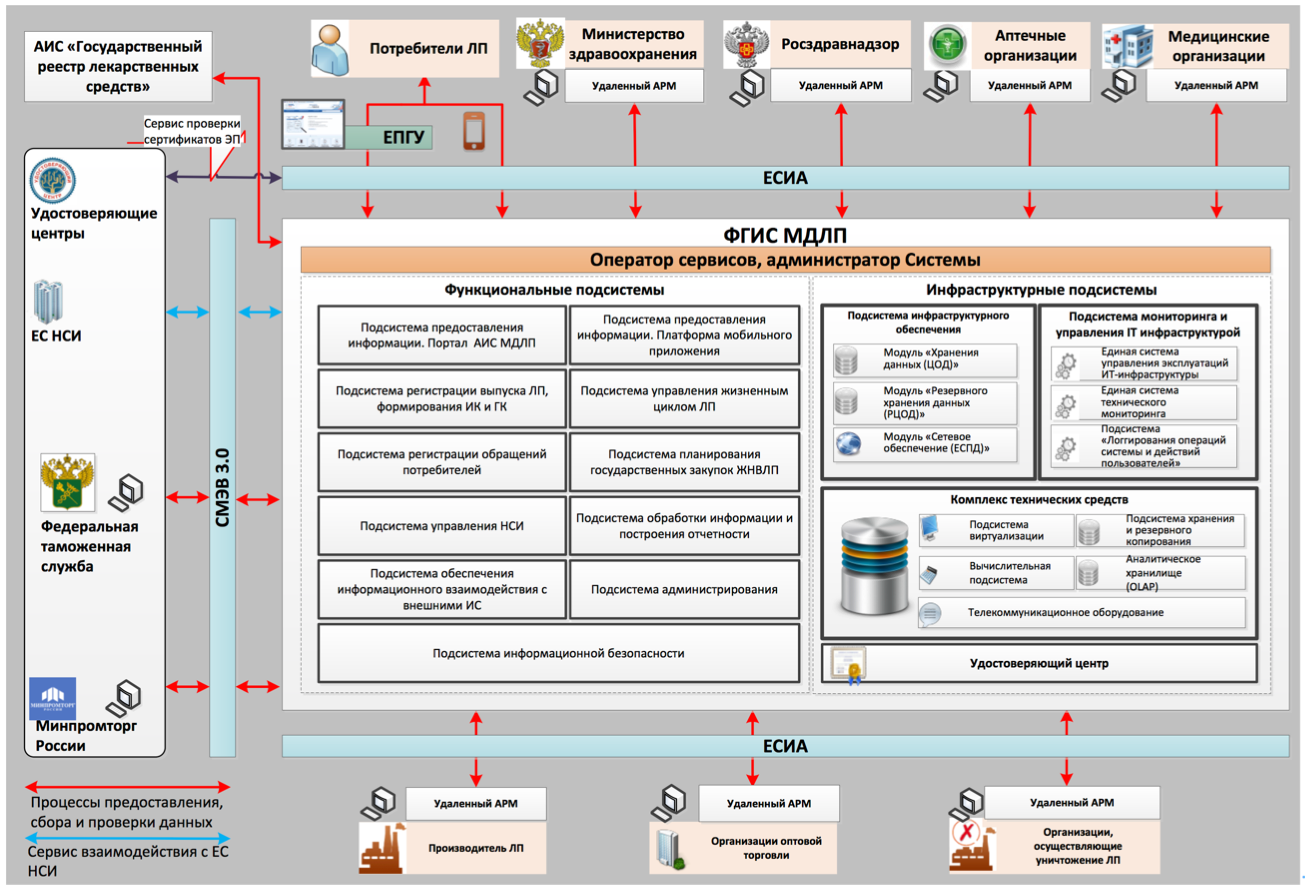
Стадии реализации
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам был утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов», доступен по адресу - http://government.ru/news/25711/.
Согласно паспорту проекта (в редакции протокола от 21 декабря 2016 года № 12) реализацию предполагалось выполнять в 2 этапа:
1. На первом этапе на территории Российской Федерации проводится эксперимент по маркировке контрольными (идентификационными) знаками лекарственных препаратов для медицинского применения для ограниченного набора препаратов преимущественно из перечня 7-ми высокозатратных нозологий.
2. На втором этапе должна осуществляться обязательна маркировка всех 100% лекарственных препаратов.
Изначально первый этап должен был продлиться с 1 января 2017 г. до 31 декабря 2017 г., однако его старт был немного сдвинут. 24 января 2017 г. Дмитрий Медведев подписал Постановление Правительства №62 «О проведении эксперимента по маркировке контрольными знаками отдельных видов лекарственных препаратов и по мониторингу за их оборотом», http://government.ru/docs/26251/. Подписанным документов был запущен эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения, под который отвели 11-месячный срок проведения: с 01.02.2017 по 31.12.2017 гг.
Второй этап планировалось выполнить с 1 января 2018 г. до 31 декабря 2018 г. Однако на фоне активного общественного обсуждения и критики проекта со стороны производителей и поставщиков препаратов они были пересмотрены, https://vademec.ru/news/2017/12/20/gosduma-prinyala-vo-vtorom-chtenii-zakonoproekt-o-markirovke-lekarstv/. В итоге 29 декабря 2017 года Президент России подписал доработанный Правительством Федеральный закон N 425-ФЗ «О внесении изменений в Федеральный закон "Об обращении лекарственных средств", http://government.ru/activities/selection/525/30944/. Согласно N 425-ФЗ, срок маркировки 100% лекарственных средств и полномасштабное использование системы (срок завершения второго этапа) перенесен на 1 января 2020 года, таким образом внедрение системы продлено на 1 год.
При этом необходимо отметить, что 425-ФЗ одновременно дает право Правительству самостоятельно устанавливать особенности и сроки внедрения системы МДЛП. Это означает, что участники оборота лекарственных средств (и, соответственно, разработчики задействованных информационных систем) должны на протяжении всего процесса внедрения отслеживать актуальные изменения порядка внедрения системы.
В соответствии с установленными полномочиями Правительством РФ изданы постановления от 14.12.2018 г. № 1556, № 1557 и № 1558.
Постановлением от 14.12.2018 г. №1556 утверждено Положение о системе мониторинга движения лекарственных препаратов для медицинского применения. Положением определяются: порядок нанесения средства идентификации, требования к его структуре и формату, его характеристики; правила создания, ввода в эксплуатацию, эксплуатации и вывода из эксплуатации системы мониторинга; порядок взаимодействия системы мониторинга с другими государственными информационными системами и информационными системами юридических лиц и индивидуальных предпринимателей, осуществляющих производство, хранение, ввоз в Россию, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов; порядок внесения в систему мониторинга и состав информации о лекарственных препаратах; порядок предоставления содержащейся в системе мониторинга информации.
Постановлением от 14.12.2018 г. №1557 установлены особенности внедрения системы мониторинга, включая сроки её внедрения, в отношении лекарственных препаратов для медицинского применения, включённых в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), а также в отношении лекарств, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов или тканей, других лекарственных препаратов для медицинского применения. Внедрение системы мониторинга таких лекарств в связи с их высокой социальной значимостью и закупками за счёт бюджетных средств является первоочередной задачей приоритетного проекта. В частности, установлено, что начиная с 1 октября 2019 года субъекты обращения таких лекарственных средств должны будут вносить сведения о лекарственных препаратах и обо всех операциях с ними в систему мониторинга.
Постановлением от 14.12.2018 г. №1558 установлен порядок размещения общедоступной информации, содержащейся в системе мониторинга, в интернете (в том числе в форме открытых данных). Общедоступная информация будет размещаться на сайте системы мониторинга её оператором. Полномочия по утверждению состава общедоступной информации, требований к периодичности размещения и сроков обновления набора данных закреплены за Минздравом России.
Как подготовиться к внедрению системы
Учитывая вышесказанное, с 1 января 2020 года любая медицинская организация, которая участвует в обороте лекарственных средств, должна работать в системе МДЛП.
Согласно Приказа Минздрава №866, аптечные организации должны:
- Выгружать из ФГИС МДЛП актуальную информацию о лекарственных препаратах, в том числе выведенных из обращения
- Загружать в ФГИС МДЛП информацию о поступлении, отгрузке, возврате, списании и передачи на уничтожение партий лекарственных препаратов
- Загружать в ФГИС МДЛП сведения, необходимые для осуществления мониторинга предельной цены на ЛП из перечня ЖВНЛП
Медицинские организации обязаны:
- Выгружать из ФГИС МДЛП актуальную информацию о лекарственных препаратах, в том числе выведенных из обращения
- Загружать в ФГИС МДЛП информацию о поступлении, отгрузке, возврате, списании и передачи на уничтожение партий лекарственных препаратов
Согласно Приказа Минздрава №866, аптечные и медицинские организации должны иметь рабочие места, оснащенные персональными компьютерами, устройствами считывания специальной маркировки, а также иметь ключи электронной подписи (ЭП), которые требуются для информационного взаимодействия с ФГИС МДЛП. Для работы с системой должно быть обеспечено подключение к Интернет. В случае отсутствия такой возможности информация может накапливается на компьютерном оборудовании аптечных и медицинских организаций и затем передаваться по определенному графику в режиме offline.
И, что совершенно логично, требуется доработать информационные системы аптечных и медицинских организаций в целях интеграции с ФГИС МДЛП для организации контроля на местах получения и отпуска лекарственных препаратов. Информация о всех операциях в процессе оборота ЛП должна автоматически передаваться из таких систем в ФГИС МДЛП.
Для этого ФНС были разработаны и опубликованы описания интеграционных профилей для разработчиков учетных систем, схемы и форматы для разработчиков учетных систем. В настоящее время указанные документы доступны на сайте нового оператора системы МДЛП - национальной системы цифровой маркировки «Честный знак» (далее - НСЦМ) - https://честныйзнак.рф/business/projects/21/#29.
Схема работы пользователей в режиме интеграции учетной системы с ФГИС МДЛП выглядит следующим образом:
1. Пользователь аптечного учреждения (или подразделения МО) получает лекарственный препарат от поставщика и сканирует маркировку (код коробки SSCC, код упаковки sGTIN)
2. Учетная система передает эти сведения в ФГИС МДЛП и получает от нее ответ:
a. Если ФГИС МДЛП «бракует» препарат – то сведения о нем автоматически фиксируются в системе и он выводится из оборота. Такой препарат должен быть возвращен поставщику для уничтожения – это подделка
b. Если ФГИС МДЛП возвращает положительный ответ, то информация о таком поступлении фиксируется в учетной системе, с ней можно работать, в том числе осуществлять выписку и выдачу препарата пациентам.
3. В случае, если препарат перемещается между подразделениями аптечной/медицинской организации – эти сведения передаются в ФГИС МДЛП.
4. Как только препарат фактически израсходован (аптечная организация продала препарат пациенту или выдала его по льготному рецепту, или в стационаре осуществили расход препарата по врачебному назначению и т.д.) – учетная система должна передать эти сведения в ФГИС МДЛП, при этом персональные данные пациента не передаются. Этим шагом учетная система выводит препарат из оборота в ФГИС МДЛП.
Отметим, что сервисы электронного взаимодействия на текущий момент находятся на стадии тестирования и переноса на новую платформу, что означает возможное изменение протоколов обмена. Ожидается, что после завершения анализа результатов эксперимента методологические рекомендации к внедрению и использованию системы МДЛП могут быть расширены и дополнены, а также, что немаловажно для разработчиков задействованных учетных систем, будут уточнены и технические детали интеграции.
В связи с этим мы рекомендуем в настоящее время проводить предварительные (начальные) мероприятия по оснащению и автоматизации аптечных и медицинских организаций в части учета лекарственных препаратов, включая:
- ознакомление с актуальными нормативными правовыми актами и описанием схемы работы системы, отслеживание изменений (тут рекомендуем пользоваться специализированными ресурсами НСЦМ и Росздравнадзора);
- разработку и издание приказа по организации внедрение системы, о назначении ответственного за внедрение и создании соответствующей рабочей группы.
- осуществление подготовки рабочих мест сотрудников: оснащение их необходимым количеством персональных компьютеров (ПК), сканеров, закупку и установку усиленной квалифицированной электронной подписи (УКЭП), ПО для работы с ней, проведение базового компьютерного обучения.
- определение и внедрение программного продукта для учета движения ЛП, если таковое еще не сделано.
- регистрацию в системе МДЛП по адресу: https://mdlp.crpt.ru. Для работы с системой придется учесть технические требования: операционная система Windows 7 или выше/ Mac OS X 10.8 или выше; браузер Internet Explorer 10 или выше / Safari 10 или выше; плагин КриптоПро для браузера Internet Explorer / Safari (http://www.cryptopro.ru/products/cades/plugin/); ПО КриптоПро ( https://www.cryptopro.ru/downloads/howto?destination=node%2F148); драйверы для работы с ключевыми носителями eToken или RuToken (скачать драйвер и инструкцию по установке можно на сайте производителя).
- проведение работы с ФГИСЗ МДЛП в тестовом режиме.
Для разработчиков аптечных систем и МИС МО реализация интеграции соответствующих учетных систем с ФГИСЗ МДЛП, на наш взгляд, пока является несколько преждевременной, по крайней мере, до публикации результатов эксперимента и официального утверждения финальных версий интеграционных механизмов. После того как эксперимент будет завершен и все необходимое программное обеспечение и сопроводительная документация ФГИСЗ МДЛП будут окончательно отлажены, можно будет приступить к детальной проработке данного вопроса и доработкам в части интеграции. Тем не менее, аптечным и медицинским организациям, а также разработчикам соответствующих информационных систем уже сейчас необходимо «подготовить почву» и активно готовится к предстоящим работам.
Для уточнения вопросов и консультирования участников проекта (аптек и медицинских организаций) в регионах России созданы специализированные «Центры компетенций». Информацию о таком центре в своем регионе можно найти по адресу - http://www.roszdravnadzor.ru/documents/47427
Следует понимать, что внедрение системы затронет все бизнес-процессы, связанные с получением, реализацией и списанием лекарственных препаратов. Поэтому, если пока данные процессы не автоматизированы внутри самой медицинской организации, то данный вопрос следует решить в самое ближайшее время.
Для этого предлагаем обратить внимание на наш продукт «КМИС.Аптека», позволяющей в полной мере решить данные задачи. Подробное описание продукта можно найти по ссылке - http://www.kmis.ru/pharmacy. Полностью налаженные и автоматизированные процессы лекарственного обеспечения внутри организации с помощью «КМИС.Аптека» позволят в будущем сделать подключение МО к ФГИС МДЛП незаметным для пользователей. Для сотрудников АСУ значительно упростится решение технической стороны вопроса – после завершения отладки протоколов интеграции со стороны ФНС, МО, которая использует в своей работе «КМИС.Аптека», вместе с обновлением получит новую версию продукта с готовым к эксплуатации интеграционным протоколом интеграции с МДЛП.
О перспективах развития системы
В планах развития системы, как отмечает министр здравоохранения России Вероника Скворцова, также стоит интеграция ФГИС МДЛП с информационно-аналитической системой (ИАС) мониторинга и контроля в сфере государственных и муниципальных закупок лекарственных препаратов, которая введена в промышленную эксплуатацию с 1 января 2018 г. Внедрение связки данных систем, совместно с использованием персонифицированного учета лекарственных средств, позволит взять под контроль весь процесс лекарственного обеспечения в рамках всей страны. При этом для работы этой системы Минздравом на основании Государственного реестра лекарственных средств (ГРСЛ) разработан единый справочник классификатор лекарственных препаратов (ЕСКЛП), а также выработаны единые принципы ведения и передачи соответствующих структурированных сведений, более подробный комментарий опубликован тут https://www.rosminzdrav.ru/news/2017/12/25/6694-soobschenie-press-sluzhby-minzdrava-rossii. Паспорт справочника ЕСКЛП доступен тут http://portal.egisz.rosminzdrav.ru/materials/607